Multiple sclerose (MS) is een hersenziekte en toch heeft deze ziekte een relatie met de darmen. In de darmen leven biljoenen bacteriën. Tussen deze bacteriën en de rest van het menselijk lichaam vindt al duizenden jaren een interactie plaats. Bij gezonde mensen heeft deze interactie een positief effect op het lichaam, maar bij mensen met klachten of een chronische aandoening lijkt de interactie tussen mens en darmbacteriën uit balans te zijn. Er is nu steeds meer bekend over deze interactie tussen mens en darmbacterie en de samenstelling van de verschillende soorten darmbacteriën (de darmflora) lijken hier een grote rol in te spelen. Bij mensen met multiple sclerose (MS) blijkt dat deze een andere darmflora hebben dan gezonde mensen. Hoe groot het effect van deze darmflora is op de gezondheid van mensen met MS bleek uit een onderzoek waarbij de klachten van drie mensen met MS verdwenen na het krijgen van een poeptransplantatie.1 Een poeptransplantatie is een behandeling waarbij mensen met een aandoening een fractie van de ontlasting van een gezond persoon toegediend krijgen. Welke rol zouden de darmen mogelijk kunnen spelen bij mensen met MS?
In dit artikel:
- multiple sclerose uitgelegd
- MS en het immuunsysteem
- wat mensen met MS missen in hun hersenen
- de link tussen de darmen en de hersenen
- wat de mogelijkheden zijn om ontstekingsreacties in de darmen en daardoor ook de kans op nieuwe relapses te verminderen
- samenvatting
- wetenschappelijke bronnen
Wat is multiple sclerose?
MS is een auto-immuunziekte waarbij het immuunsysteem delen van het zenuwstelsel in de hersenen en ruggenmerg aanvalt. Hierdoor verdwijnt er myeline. Myeline is de beschermlaag die om de uiteinden van de zenuwvezels zit. Bij een gebrek aan myeline kunnen zenuwcellen minder goed met elkaar communiceren. Hierdoor ervaren mensen met MS allerlei verschillende soorten klachten, zoals spasmen, tintelingen, vermoeidheid, slecht zicht en spierzwakte. Tegenwoordig bestaan er goede behandelingen voor MS waarbij nieuwe beschadigingen in de hersenen en ruggenmerg worden voorkomen. Maar er zijn in Nederland nog geen behandelingen die ervoor zorgen dat de verdwenen myeline weer herstelt.
MS en het immuunsysteem
Het lichaam is in principe in staat verdwenen myeline te herstellen als dit nodig is.2 Maar bij mensen met MS gebeurt dit niet. Een mogelijke verklaring ligt in de werking van het immuunsysteem en de communicatie van het immuunsysteem. Een belangrijk onderdeel van de communicatie van het immuunsysteem is een kleine molecuul: de cytokine. De verschillende componenten van het immuunsysteem kunnen met elkaar communiceren door bepaalde cytokinen af te vuren. Cytokinen zijn eiwitten waarvan er verschillende soorten in ons lichaam actief zijn. Zo kan een cytokine het signaal doorgeven dat er een virus in het lichaam is gedetecteerd, zodat het immuunsysteem dit op kan ruimen. Nou zijn er zowel ontstekingsbevorderende als ontstekingsremmende cytokinen. Bij een gezond persoon zijn het aantal ontstekingsbevorderende cytokinen en het aantal ontstekingsremmende cytokinen met elkaar in balans. Een teveel aan ontstekingsbevorderende cytokinen zorgt voor ontstekingen en kan uiteindelijk tot auto-immuunziekten leiden, waarbij het immuunsysteem dus delen van het eigen lichaam aanvalt.3 Ook mensen met MS hebben meer ontstekingsbevorderende cytokinen in het bloed en de hersenen dan gezonde mensen.4 5 6
Een onderzoek in de jaren ’80 van de 20ste eeuw waarbij ze een bepaalde ontstekingingsbevorderende cytokine aan 18 MS patiënten gaven, had ook een negatief effect: hun MS-gerelateerde klachten namen toe!7 Hoopgevend is een onderzoek waarbij de onderzoekers 15 MS patiënten een jaar lang een middel gaven die een bepaalde ontstekingsbevorderende cytokine moest afremmen. De proefpersonen ervoeren hierdoor een verbetering van hun klachten.8 Een mogelijke verklaring hiervoor is het effect dat dat ontstekingsbevorderende cytokinen hebben op belangrijke hersencellen.
Myeline, een nuttige beschermlaag
Myeline is een vettige stof die als een beschermlaag om de zenuwvezels (axons) in de hersenen en de ruggenmerg heen is gevouwen. Door de aanwezigheid van myeline kunnen zenuwcellen veel sneller met elkaar communiceren. Wanneer myeline, zoals bij MS het geval is, ontbreekt gaat de communicatie tussen de zenuwcellen veel trager. En in sommige gevallen bereiken de signalen het andere eind van de axons niet meer, waardoor mensen met MS allerlei soorten klachten ervaren. Nieuwe myeline wordt aangemaakt door oligodendrocyten. Oligodendrocyten zijn cellen die zich in het centrale zenuwstelsel bevinden en het ontwikkelen van nieuwe myelinge als hoofdfuntie hebben.
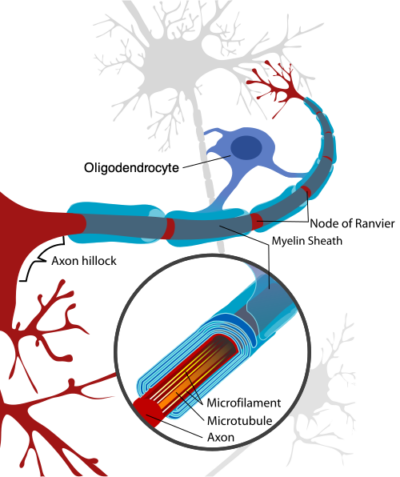
Oligodendrocyten speuren door de hersenen op zoek naar (nieuwe) verbindingen die nog geen myeline laagje hebben. Als een oligendrocyt een lege axon gevonden heeft, reikt hij met zijn armen naar de lege axon uit om op deze plek myeline te vormen. Een oligodendrocyt heeft meerdere vertakkingen en is daardoor in staat om op meerdere plekken tegelijkertijd myeline aan te maken. Oligodendrocyten spelen dus een belangrijke rol in de genezing van MS. Het probleem is echter dat deze oligodendrocyten afsterven als zij in aanraking komen met bepaalde ontstekingsbevorderende cytokinen.9 10 De aanwezigheid van ontstekingsbevorderende cytokinen kan dus verklaren dat mensen met MS hun klachten houden.
Wat hebben de darmen te maken met deze cytokinen?
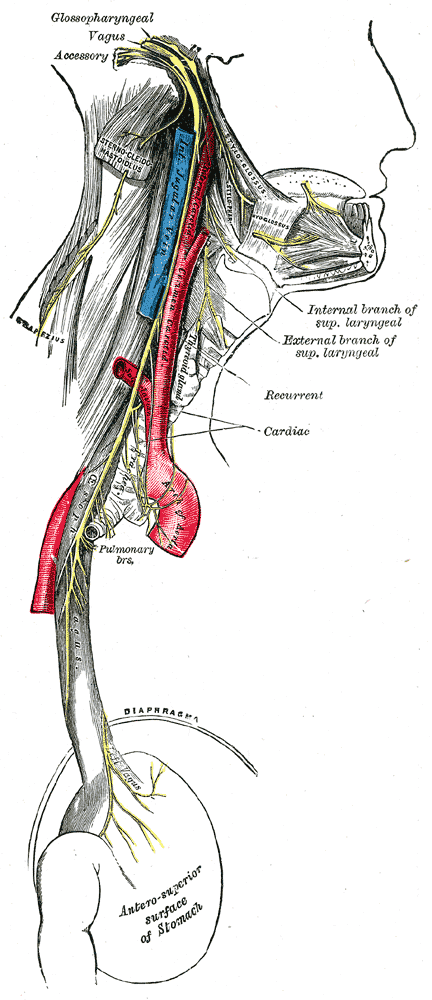
Een mogelijke oorzaak is te vinden in de darmen. Zoals eerder gezegd, mensen met MS hebben een andere darmflora dan mensen zonder MS. Welke bacteriën en schimmels er in de darmen leven en welke voeding zij krijgen hebben een invloed op het immuunsysteem. En de cytokinen die in de darmen door het immuunsysteem worden afgevuurd, om de boel daar in balans te houden, zijn ook terug te zien in het centrale zenuwstelsel (de hersenen en ruggenmerg). Er loopt namelijk een grote zenuw tussen de hersenen en de dikke darm: de nervus vagus. De nervus vagus is de langste zenuw in het menselijk lichaam en loopt van de schedel naar beneden, langs het hart, de longen, de maag en komt uiteindelijk uit bij de darmen. Er wordt altijd gesproken over dé nervus vagus, maar in principe zijn het er twee: een linker en een rechter. Deze zenuw speelt een belangrijke rol in het immuunsysteem. De nervus vagus is namelijk in staat de signalen van de cytokinen die zich in de darmen bevinden door te geven aan de hersenen, en andersom.11 Ontstekingsreacties die zich in de darmen bevinden, worden daardoor ook aangewakkerd in de hersenen.

Dit wil overigens niet zeggen dat ontstekingen in de darmen de enige oorzaak zijn van ontstekingsreacties in de hersenen bij MS. Uit onderzoek blijkt namelijk dat mensen met MS, net als mensen met autisme, meer schadelijke metalen in hun hersenen en bloed hebben dan mensen zonder MS.12 13 Zoals ik in dit artikel heb beschreven, lijkt een gebrek aan bepaalde ontgiftingsenzymen bij autisme hier een grote rol bij te spelen. Nou wil het toeval dat een van die ontgiftingsenzymen bij mensen met MS een genetische afwijking heeft.14 Ontgiftingsenzymen bevinden zich in de cellen van de maag- en darmwand en kunnen aangewakkerd worden als zij in contact komen met een stofje dat zich bevindt in kruisbloemige groenten.15 Dit stofje heeft sulforafaan. Grote hoeveelheden sulforafaan zijn vooral te vinden in broccolikiemen. Of de consumptie van broccolikiemen om die reden een gunstig effect hebben op MS moet nog onderzocht worden.
En mogelijk zijn er nog meer zaken die een rol spelen bij de activering van ontstekingsreacties in de hersenen van mensen met MS.
Ontstekingen in de darmen
Er kunnen verschillende redenen zijn waarom mensen met MS ontstekingsreacties hebben in de darmen. Zo is bekend dat veel mensen met MS een lekkende darm hebben (ook wel bekend als een doorlaatbare darm).16 Een lekkende darm betekent dat de darmwand beschadigd is, waardoor er allerlei bacteriën, gisten, virussen, voedsel en giftige stoffen in de bloedbaan terecht komen. Om verdere beschadigingen te voorkomen, worden er op deze plek ontstekingsbevorderende cytokinen afgevuurd.17 Daarnaast kan de aanwezigheid van bepaalde gisten en bacteriën ook tot ontstekingsreacties leiden.18 19 20 Veel mensen met MS hebben bijvoorbeeld een teveel aan de schimmel Candida albicans.21 De Candida albicans is niet per definitie schadelijk, maar een teveel aan deze schimmel heeft een negatief effect. En bij enkele anekdotische gevallen lijkt het bestrijden van de Candida albicans tot een vermindering van MS-klachten te zorgen.22 En uiteraard heeft niet iedereen met ontstekingsreacties in de darmen MS. Hier zit ook een genetische component aan. Mensen hebben een grotere kans om MS te ontwikkelen als iemand in de familie ook de diagnose MS heeft.23
Ontstekingen verminderen
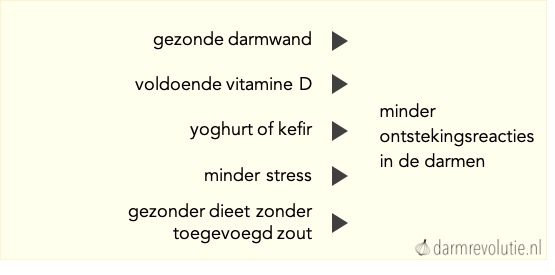
Er zijn verschillende mogelijkheden om ontstekingsreacties in de darmen te verminderen. Dit zijn (onder andere):
- Het herstellen van een lekkende darm
- Het vermijden van voedingsmiddelen die voor ontstekingen zorgen in de darmen
- Het eten van gefermenteerde groenten of yoghurt
- Het slikken van vitamine D supplementen
- Het vermijden van stress
- Het aanmoedigen van gunstige bacteriën door voedingsvezels te eten.
Herstellen lekkende darm
Een doorlaatbare of lekkende darm wil zeggen dat de darmwand niet meer intact is en dat er bacteriën, gisten, virussen, toxische stoffen en etensresten uit de darm kunnen ontsnappen en in de bloedbaan terecht kunnen komen. Wanneer de darmwand beschadigd is, wordt het immuunsysteem geactiveerd om juist die ziekteverwekkers te lijf te gaan.24 Deze beschadigingen in de darmwand zijn te herstellen door onder andere veel voedingsvezels te eten, vetrijke maaltijden te vermijden en periodiek te vasten. Periodiek vasten wordt ook wel intermittent fasting genoemd en betekent dat iemand bijvoorbeeld 14 of 16 uur op een dag niet eet. Dit kan bijvoorbeeld door na het avondeten niet meer te snacken en alleen caloriearme dranken te nemen en later te ontbijten. Ook zink supplementen kunnen een goede aanvulling zijn voor de gezondheid van de darmwand. (In dit artikel heb ik meer geschreven over het ontstaan en herstel van een lekkende darm.)
Vermijd verkeerde voeding
Wie de verkeerde dingen eet, is zijn het immuunsysteem in de darmen aan het uitdagen om het lichaam te beschermen tegen eventuele ziekteverwekkers. Het immuunsysteem wordt dan getriggerd om ontstekingsreacties af te vuren. Een manier om het immuunsysteem in de darmen meer in balans te brengen, is door gezonder te gaan eten. Voedingsmiddelen die ontstekingsreacties opwekken zijn vlees, vetten, alcohol, suiker en zoetstoffen, allemaal onderdelen van het zogenaamde Westerse dieet. (Lees hier meer over in dit artikel).
De effecten van Westerse dieet op MS zijn in meerdere studies onder de loep gelegd. De meest opvallende studie is een 34-jarige studie van dr. Swank, waarbij een grote groep MS-patiënten een vetarm dieet volgden. De proefpersonen consumeerden minder dan 20 gram vet per dag. Dit betekent dat zij ook nauwelijks dierlijke producten aten zoals vlees, kaas en roomboter, omdat die over het algemeen vetrijk zijn. Na 34 jaar werd de voortgang van de ziekte van de proefpersonen vergeleken met mensen die wel meer dan 20 gram vet per dag consumeerden. De resultaten waren opvallend! De mensen die een vetarm dieet volgden bleven lange tijd stabiel (de studie was gedaan in een periode dat er nauwelijks medicatie was voor mensen met MS) en deze groep had een lager sterftecijfer dan de mensen die een vetrijker dieet volgden.25
In een meer recentere studie volgden onderzoekers een jaar lang een groep proefpersonen met MS die ofwel een Westers dieet volgden of een dieet met veel groenten en weinig dierlijke eiwitten. De mensen die het gezondere dieet volgden hadden niet alleen minder ontstekingsreacties in hun darmen, maar ook minder relapses dan de proefpersonen die het Westerse dieet volgden.26
Probiotica
Uit verschillende onderzoeken is gebleken dat van verschillende soorten Lactobacilli (een gunstige bacteriesoort) de aanmaak van ontstekingsbevorderende cytokinen verminderen.27 28 29 30 Mogelijk komt dit omdat Lactobacilli als natuurlijk vijand op kunnen treden tegen ziekteverwekkende bacteriën.31 Lactobacilli zijn te verkrijgen als probiotica. Probiotica zijn levende micro-organismen te vinden zijn in supplement of in bepaalde voedingsmiddelen zoals yoghurt, kefir en gefermenteerde groenten. Voorbeelden van gefermenteerde groenten zijn zuurkool, de Koreaanse kimchi en de Japanse tsukemono’s. Het nadeel van gefermenteerde groenten is echter, dat er veel zout nodig is om het fermentatieproces op gang te brengen. En zout heeft juist weer een nadelig effect op de darmen en op MS. Dit stip ik verder aan onder het kopje ‘Vermijd stress‘.
Wat gebeurt er dan als mensen met MS dagelijks probiotica krijgen? In een onderzoek uit 2017 werd dit uitgetest. Een groep van 60 proefpersonen met MS werd in tweeën gesplitst. De ene helft kreeg 12 weken lang dagelijks een pilletje met verschillende soorten Lactobacilli en ook het gezonde Bifidobacterium bifidum. De andere helft ontving een placebo. Bij de mensen die dagelijks het probiotica supplement namen, was een verbetering van hun klachten merkbaar.32
Vitamine D
Een andere manier om ontstekingreacties in de darmen te verminderen is met vitamine D supplementen.33 Zo bleek uit een onderzoek waarbij mensen met een darmontsteking (colitis) gedurende 8 weken elke week vitamine D supplementen kregen met een waarde van 40.000 internationale eenheden (IE). Na deze periode hadden de proefpersonen minder ontstekingswaarden in hun bloed.34 Omgerekend is 40.000 IE per week meer dan 5.000 IE per dag. Ook in een ander onderzoek waarbij patiënten van de ziekte van Crohn vitamine D supplementen kregen, testten de onderzoekers hoeveel vitamine D er nodig was om ontstekingen in de darmen te verminderen. Ze begonnen met een dosis van 1.000 IE per dag en verhoogden dat gaandeweg. Pas bij een dosis van 5.000 IE per dag begonnen ze effect te merken: de ontstekingen en klachten van de proefpersonen met de ziekte van Crohn namen toen af. 35 Dit zijn andere aantallen dan de vitamine D supplementen die in de Nederlandse drogisterijen verkocht worden: dit zijn meestal pillen van slechts 400 IE. Daar zit dus nogal een verschil in. En uit verschillende onderzoeken blijkt dat vitamine D ook een invloed heeft op MS. Zo komt MS minder voor in landen die dicht bij de evenaar wonen.36 Ook hebben mensen die meer vitamine D slikken een verlaagde kans op het ontwikkelen van MS.37
Het lichaam van een volwassene verbruikt heeft dagelijks 3.000 tot 5.000 IE aan vitamine D nodig.38 Een menselijk lichaam maakt vitamine D aan als er voldoende zonlicht is. Mensen die in Noord-West Europa wonen, maken de meeste vitamine D aan als ze in de zomer rond het middaguur in de volle zon in bikini plat op de grond gaat liggen.39 ’s Ochtends en ’s avonds is de zon in de zomer niet sterk genoeg om vitamine D aan te maken. En in de winter al helemaal niet. In Nederland is een vitamine D tekort dus snel opgebouwd. Professor George Jelinek, die het Overcoming Multiple Sclerosis programma heeft ontwikkeld, raadt daarom een dagelijkse dosis van 5.000 tot 10.000 IE per dag aan voor mensen met MS. En wie besluit om ook vitamine D pillen met een dosis van 5.000 IE te nemen, hoeft niet te vrezen voor een vitamine D vergiftiging. Een inname van 10.000 IE vitamine D per dag is namelijk veilig.40
Vermijd stress
Stress zorgt ervoor dat schadelijke bacteriën in aantallen toenemen in de darmen, terwijl gezonde bacteriën in aantallen afnemen.41 Daarnaast leidt stress ook tot het ontstaan van ‘lekken’ in de darmwand42 43 en dat is juist iets wat mensen met MS beter kunnen vermijden. Het verminderen van stress door bijvoorbeeld meditatie of mindfulness werpt in ieder geval bij darmziekten als het Prikkelbare Darm Syndroom, de ziekte van Crohn en colitis ulcerosa zijn vruchten af.44 45 (In dit artikel heb ik meer geschreven over de effecten van stress op de darmen.) Het stresshormoon cortisol heeft dan ook een relatie met MS. Mensen met een (actieve) MS hebben namelijk meer cortisol in hun lichaam dan mensen zonder MS.46 47 48
Daarnaast lijkt het mogelijk stress te verminderen door minder zout te eten of helemaal te stoppen met zout. Wanneer onderzokers namelijk zout aan muizenvoer toevoegen, ontstaat er een shift in de darmflora met een nadelig effect. Door deze shift leven er namelijk meer bacteriën in de darmen die de aanmaak van stresshormonen stimuleren.49 Of zoutconsumptie dan ook bij mensen voor meer stress zorgt, blijkt uit een onderzoek dat in Hong Kong is uitgevoerd. In dit onderzoek werden studenten ondervraagd over hun zoutconsumptie en hun stressniveau. En de studenten die het meeste zout aten, ervoeren ook het meeste stress.50 Tevens blijkt uit een ander onderzoek dat als muizen zout krijgen, er ook meer ontstekingsreacties in hun darmen te vinden zijn.51 Wat voor effect heeft zout dan op MS? Uit een studie waarbij onderzoekers de zoutinname van mensen met Relapsing Remetting MS onderzochten, bleek dat hoe meer zout de proefpersonen aten, hoe actiever de MS was.52
Gunstige bacteriën aanmoedigen met voedingsvezels
Mensen met MS hebben minder Bifidobacteriën53 54 en butyraat-producerende bacteriën55 56 dan gezonde mensen. En Bifidobacteriën dragen bij aan de productie van een gunstige korte-keten vetzuur: butyraat (ook wel bekend als boterzuur). Butyraat is een product die darmbacteriën produceren en waar het menselijk lichaam veel baat bij heeft. Vooral bij mensen met MS kan butyraat van nut zijn: butyraat moedigt namelijk de aanmaak van nieuwe oligodendrocyten aan, die nodig zijn voor de ontwikkeling van nieuwe myeline.57 Daarnaast remt butyraat ontstekingsreacties in de darmen af en brengt het het immuunsysteem meer in balans.58
Bifidobacteriën bevorderen de productie van butyraat, ondanks dat ze zelf geen butyraat aanmaken: de butyraat producerende bacteriën lijken namelijk meer butyraat te maken in de aanwezigheid van Bifidobacteriën dan in hun afwezigheid.59 60 Voor meer butyraat is het mogelijk de groei van zowel Bifidobacteriën als butyraat-producerende bacteriën te stimuleren. Dit kan door het consumeren van prebiotica, of voedingsvezels.
Wat zijn prebiotica?
Prebiotica zijn iets anders dan probiotica. Probiotica zijn levende bacteriën. Prebiotica zijn de fermenteerbare voedingsvezels waarmee gezonde darmbacteriën zich voeden. Deze fermenteerbare voedingsvezels zijn vooral te vinden in: uien, knoflook, prei, bosui, peulvruchten (bonen, linzen en kikkererwten), Fries roggebrood, afgekoelde aardappels, afgekoelde rijst, groene bananen, mais, tarwekiemen, sinaasappels, gewone wortels en witlofwortels. Ook zijn er prebiotica supplementen te bestellen onder de volgende namen:
- inuline (in pure vorm of in korrels van gedroogde witlofwortel)
- fructo-oligosacchariden (FOS)
- xylo-oligosacchardiden (XOS)
- galacto-oligosacchariden (GOS)
- gedeeltelijk gehydraliseerde guargum.
Mensen die niet gewend zijn aan deze prebiotica, kunnen na de consumptie van een van bovengenoemde producten last krijgen van een opgeblazen buik. Maar dit opgeblazen gevoel verdwijnt gelukkig na regelmatige consumptie.

Wil je mij bedanken voor al het werk dat ik heb geleverd voor het schrijven van dit artikel? Dit kan door te doneren. Doneren kan hier.
Samengevat
De ontstekingen die bij multiple sclerose een grote rol spelen, zijn te beïnvloeden met voeding. MS is een auto-immuunziekte waarbij het immuunsysteem zo uit balans is, dat het eigen lichaam wordt aangevallen. In het geval van MS wordt de beschermlaag van zenuwcellen in de hersenen en ruggenmerg, genaamd myeline, aangetast. Uit steeds meer onderzoeken is bekend dat mensen met MS een andere darmflora hebben dan gezonde mensen en dat de darmflora een rol speelt in het ziekteverloop van MS. Een lekkende darm, verkeerde voeding, stress en een afwijkende darmflora kunnen voor ontstekingsreacties zorgen. De ontstekingsreacties in de darmen worden door een speciale zenuw doorgegeven aan componenten van het immuunsysteem in de hersenen, waardoor er ook ontstekingsreacties in de hersenen kunnen plaatsvinden. Speciale darmflora testen kunnen uitwijzen welke schimmels of bacteriën in de darmen voor ontstekingsreacties kunnen zorgen. Gefermenteerde voeding, zoals yoghurt en kimchi, en vitamine D supplementen kunnen in ieder geval bepaalde ontstekingsreacties verminderen. Daarnaast kunnen gezonde voedingsvezels (prebiotica) zorgen voor meer gezonde darmbacteriën en de aanmaak van het stofje butyraat, dat de ontwikkeling van nieuwe myeline activeert.
__________________________________________________
Disclaimer: De auteur van darmrevolutie.nl, Jacqui Bolt, is geen praktiserend arts. Met deze artikelen probeer ik slechts de resultaten van wetenschappelijke onderzoeken weer te geven. Mensen die klachten ervaren worden geadviseerd hun behandelend arts te raadplegen.
Bronnen
- Borody, T., et al. 2011: Fecal Microbiota Transplantation (FMT) in Multiple Sclerosis (MS). American Journal of of Gastroenterology 106, p. S352. [Google Scholar]
- Blakemore, W.F. & A.J. Crang, 1988: Extensive Oligodendrocyte Remyelination following Injection of Cultured Central Nervous System Cells into Demyelinating Lesions in Adult Central Nervous System. Developmental Neuroscience 10, p. 1-11. [PubMed] [Google Scholar]
- Virtanen, A.T., T. Haikarainen, J. Raivola & O. Silvennoinen, 2019: Selective JAKinibs: Prospects in Inflammatory and Autoimmune Diseases. BioDrugs 33(1), p. 15-32. [PubMed] [Google Scholar]
- Wang, K., et al. 2018: The Properties of Cytokines in Multiple Sclerosis: Pros and Cons. The American Journal of Medical Sciences 356 (6), p. 552-560. [PubMed] [Google Scholar]
- Kallaur, A.P., et al. 2013: Cytokine profile in relapsing-remitting multiple sclerosis patients and the association between progression and activity of the disease. Molecular Medicine Reports. [PubMed] [Google Scholar]
- Sun, et al. 1991: Autoreactive T en B cells responding to myelin proteolipid protein in multiple sclerosis and controls. European Journal of Immunology. [PubMed] [Google Scholar]
- Panitch, H.S, A.S. Haley, R.L. Hirsch & K.P. Johnson, 1987: Exacerbations of Multiple Sclerosis in Patients Treated with Gamma Interferon. The Lancet 329(8538), p. 893-895. [PubMed] [Google Scholar]
- Skurkovich, S. et al. 2001: Randomized study of antibodies to INF-g and TNF-a in secondary progressive multiple sclerosis. Multiple Sclerosis Journal. [PubMed] [Google Scholar]
- Baerwald, K.D. & B. Popko, 1998: Developing and mature oligodendrocytes respond differently to immune cytokine interferon gamma. Journal of Neuroscience Research. [PubMed] [Google Scholar]
- Paintlia, M.K., A.S. Paintlia, A.K. Singh & I. Singh, 2010: Synergistic activity of interleukin-17 and tumor necrosis factor-a enhances oxidative stress-mediated oligodendrocyte apoptosis. Journal of Neurochemistry. [PubMed] [Google Scholar]
- Maier, S.F., L.E. Goehler, M. Fleshner & L.R. Watkins, 2006: The Role of the Vagus Nerve in Cytokine-to-Brain Communication. Annals of The New York Academy of Sciences. [PubMed] [Google Scholar]
- Mold, et al. 2018: Aluminium in Brain Tissue in Multiple Sclerosis. Environmental Reseearch and Public Health 15(8): 1777. [PubMed] [Google Scholar]
- Attar, A.M., A. Kharkhaneh, M. Etemadifar, K. Keyhanian, V. Davoudi & M. Saadatnia. Biological Trace Element Research 146, p. 150-153. [PubMed] [Google Scholar]
- Barjui, S.P., S. Reiisi & A. Bayati, 2017: Human glutathione s-transferase enzyme gene variations and risk of multiple sclerosis in Iranian population cohort. Multiple Sclerosis and Related Disorders 17, p. 41-46. [PubMed] [Google Scholar]
- Munday, R. & C.M. Munday, 2004: Induction of phase II detoxification enzymes in rats by plant-derived isothiocyanates: comparison of allyl isothiocyanate with sulforaphane and related compounds. Journal of Agricultural and Food Chemistry 53(7), p. 1867-1871. [Pubmed] [Google Scholar]
- Buscarinu, M.C. et al. 2018: Intestinal Permeability in Relapsing-Remitting Multiple Sclerosis. Neurotherapeutics 15, p. 68-74. [PubMed] [Google Scholar]
- Lee, J.S. et al. 2015: Interleukin-23-Independent IL-17 Production Regulates Intestinal Epithelial Permeability. Immunity 43(4), p. 727-738. [PubMed] [Google Scholar]
- Cekanaviciute, E. et al. 2018: Multiple Sclerosis-Associated Changes in the Composition and Immune Functions of Spore-Forming Bacteria. mSystems. [PubMed] [Google Scholar]
- Greer, R.L. et al. 2016: Akkermansia muciniphila mediates negative effects of IFNg on glucose metabolism. Nature Communications 7. [PubMed] [Google Scholar]
- Gozalbo, D. & M.L. Gil, 2009: IFN-gamma in Candida albicans infections. Frontiers in Bioscience (Landmark Edition), 14, p. 1970-1978. [PubMed] [Google Scholar]
- Saroukolaei, S.A., M. Ghabaee, H. Shokri, A. Badiei & S. Ghourchian, 2016: The role of Candida albicans in the severity of multiple sclerosis. Mycoses Diagnoses, Therapy and Prophylaxis of Fungal Diseases. [PubMed]
- Truss, C.O., 1981: The Role of Candida Albicans in Human Illness. Orthomolecular Psychiatry 10(4), p. 228-238. [Google Scholar]
- Sadovnick, A.D., D.A. Dyment, G.C. Ebers & N.J. Risch, 1996: Evidence for genetic basis of multiple sclerosis. The Lancet 347(9017), p. 1728-1730. [PubMed] [Google Scholar]
- Lee, J.S. et al. 2015: Interleukin-23-Independent IL-17 Production Regulates Intestinal Epithelial Permeability. Immunity 43(4), p. 727-738. [PubMed] [Google Scholar]
- Swank, R.L. & B.B. Dugan, 1990: Effect of low saturated fat diet in early and late cases of multiple sclerosis. The Lancet 336, p. 37-39. [PubMed] [Google Scholar]
- Saresella, M. et al. 2017: Immunological and Clinical Effect of Diet Modulation of the Gut Microbiome in Multiple Sclerosis Patients: A Pilot Study. Frontiers in Immunology 8. [PubMed] [Google Scholar]
- Rizzo, A. et al. 2013: Lactobacillus plantarum reduces Streptococcus pyogens virulence by modulating the IL-17, IL-23 and Toll-like receptor 2/4 expressions in human epithelial cells. International Immunopharmacology 17(2), p. 453-461. [PubMed] [Google Scholar]
- Prakoeswa, C.R.S. et al. 2017: Lactobacillus plantarum IS-10506 supplementation reduced SCORAD in children with atopic dermatitis. Beneficial Microbes 8(5), p. 833-840. [PubMed] [Google Scholar]
- Santiago-Lopez, L. et al. 2018: Effect of Milk Fermented with Lactobacillus fermentum on the Inflammatory Response in Mice. Nutrients 10(8). 1039. [PubMed] [Google Scholar]
- Kosler, S., B. Strukeij & A. Berlec, 2017: Lactic Acid Bacteria with Concomitant IL-17, IL-23 and TNFa- Binging Ability for the Treatment of Inflammatory Bowel Disease. Current Pharmaceutical Biotechnology 18(4). [PubMed] [Google Scholar]
- Servin, A.L. & M.H. Coconnier, 2003: Adhesion of probiotic strains to the intestinal mucosa and interaction with pathogens. Best Practice & Research Clinical Gastroenterology 17 (5), p. 741-754. [PubMed] [Google Scholar]
- Kouchaki, E. et al. 2017: Clinical and metabolic response to probiotic supplementation in patients with multiple sclerosis: A randomized, double-blind, placebo-controlled trial. Clinical Nutrition 36(5), p. 1245-1249. [PubMed] [Google Scholar]
- Cantorna, M. et al. 2014: Vitamin D, immune regulation, the microbiota, and inflammatory bowel disease. Experimental Biology and Medicine. [PubMed] [Google Scholar]
- Garg, M. et al. 2018: The Effect of Vitamin D on Intestinal Inflammation and Faecal Microbiota in Patients with Ulcerative Colitis. Journal of Crohn’s and Colitis 12(8), p. 963-972. [PubMed] [Google Scholar]
- Yang, L. et al. 2013: Therapeutic Effect of Vitamin D Supplementation in a Pilot Study of Crohn’s Patients. Clinical and Translational Gastroenterology. 4(4): e33. [PubMed] [Google Scholar]
- Kampman, M.T. & M. Brustad, 2008: Vitamin D: A candidate for the Environmental Effect in Multiple Sclerosis – Observations from Norway. Neuroepidemiology 30, p. 140-146. [PubMed] [Google Scholar]
- Munger, K.L. et al. 2006: Serum 25-Hydroxyvitamin D Levels and Risk of Multiple Sclerosis. JAMA 296(23), p. 2832-2838. [PubMed] [Google Scholar]
- Heaney, R.P., K.M. Davies, T.C. Chen, M.F. Holick, M.J. Barger-Lux, 2003: Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. The American Journal of Clinical Nutrition 77(1), p. 204-210. [PubMed] [Google Scholar]
- Webb, A.R., R. Kift, J.L. Berry & L.E. Rhodes, 2011: The Vitamin D Debate: Translating Controlled Experiments into Reality for Human Sun Exposure Times. Photochemistry and Photobiology 87(3), p. 741-745. [PubMed] [Google Scholar]
- Holick, M.F., 2010: Vitamin D and Health: Evolution, Biologic Functions, and Recommended Dietary Intakes for Vitamin D. Vitamin D, p. 3-33. [Google Scholar]
- Zijlmans, M.A.C, K. Korpela, J.M. Riksen-Walraven, W.M. de Vos & C. de Weerth, 2015: Maternal prenatal stress is associated with the infant intestinal microbiota. Psychoneuroendocrinology 53, p. 233-245. [PubMed] [Google Scholar]
- Kelly, J.R., P.J. Kennedy, J.F. Cryan, T.G. Dinan, G. Clarke & N.P. Hyland, 2015: Breaking down the barriers: the gut microbiome, intestinal permeability and stress-related psychiatric disorders. Frontiers in Cellular Neuroscience 9: 392. [PubMed] [Google Scholar]
- Punder, K. de & L. Pruimboom, 2015: Stress Induces Endotoxemia and Low-Grade Inflammation by Increasing Barrier Permeability. Frontiers in Immunology 6: 223. [PubMed] [Google Scholar]
- Folks, D.G., 2004: The Interface of Psychiatry and Irritable Bowel Syndrome. Current Psychiatry Reports 6, p. 210-215. [PubMed] [Google Scholar]
- González-Moret, R., et al. 2020: The effect of a mindfulness-based therapy on different biomarkers among patients with inflammatory bowel disease: a randomised controlled trial. Scientific Reports 10: 6071. [PubMed] [Google Scholar]
- Pereira, G.M., N.M. Soares, A.R. de Souza, J. Becker, A. Funkelsztejn & R.M.M. de Almeida, 2018: Basal cortisol levels and the relationship with clinical symptoms in multiple sclerosis: a systematic review. Arquivos de Neuro-Psiquiatria 76(8). [PubMed] [Google Scholar]
- Erkut, Z.A. et al. 2002: Cortisol is increased in postmortem cerebrospinal fluid of multiple sclerosis patients: relationship with cytokines and sepsis. Multiple Sclerosis Journal 8(3), p. 229-236. [PubMed] [Google Scholar]
- Kern, S., I. Krause, A. Horntrich, K. Thomas, J. Aderhold & T. Ziemssen, 2013: Cortisol Awakening Response Is Linked to Disease Course and Progression in Multiple Sclerosis. Plos One 8(4): e60647. [PubMed] [Google Scholar]
- Jones, A.Y.M. & E. Dean & S.K. Lo, 2009: Interrelationships Between Anxiety, Lifestyle Self-reports and Fitness in a Sample of Hong Kong University Students. The International Journal on the Biology of Stress 5(1), p. 65-71. [PubMed] [Google Scholar]
- Jones, A.Y.M. & E. Dean & S.K. Lo, 2009: Interrelationships Between Anxiety, Lifestyle Self-reports and Fitness in a Sample of Hong Kong University Students. The International Journal on the Biology of Stress 5(1), p. 65-71. [PubMed] [Google Scholar]
- Elijjovich, F., C.L. Laffer, M. Sahinoz, A. Pitzer, J.F. Ferguson & A. Kirabo, 2020: The Gut Microbiome, Inflammation, and Salt-Sensitive Hypertension. Current Hypertension Reports 22: 79. [PubMed] [Google Scholar]
- Farez, M.M., M.P. Fiol, M.I. Gaitán, F.J. Quintana & J. Correale, 2015: Sodium intake is associated with increased disease activity in multiple sclerosis. Neurology, Neurosurgery & Psychiatry 86(1), p. 26-31. [Pubmed][Google Scholar]
- Wagenfeld, K. 1991: Occurence of bifidobacteria in the stool of multiple sclerosis patients. Zentralblatt fur Bakteriologie: international journal of microbiology 275 (4), 541-8. [PubMed] [Google Scholar]
- Toghi, M. et al. 2019: Bifidobacteria: A probable missing puzzle piece in the pathogenesis of multiple sclerosis. Multiple Sclerosis and Related Disorders 36. [PubMed] [Google Scholar]
- Jangi, S. et al. 2016: Alterations of the human gut microbiome in multiple sclerosis. Nature Communications 7. [PubMed] [Google Scholar]
- Miyake, S., et al. 2015: Dysbiosis in the Gut Microbiota of Patients with Multiple Sclerosis, with a Striking Depletion of Species Belonging to Clostridia XIVa and IV Clusters. PloS One. [PubMed] [Google Scholar]
- Chen, T., et al. 2019: Butyrate suppresses demyelination and enhances remyelination. Journal of Neuroinflammation 16. [PubMed] [Google Scholar]
- Furusawa, Y., et al. 2013: Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature 504, p. 446-450. [PubMed] [Google Scholar]
- Rios-Covian, D. et al. 105: Enhanced butyrate formation by cross-feeding between Faecalibacterium prausnitzii and Bifidobacterium adoloscentis. FEMS Microbiology Letters 362 (21). [PubMed] [Google Scholar]
- Belenguer, A. et al. 2006: Two Routes of Metabolic Cross-Feeding between Bifidobacterium adolescentis and Butyrate-Producing Anaerobes from the Human Gut. Applied and Environmental Microbiology. [PubMed] [Google Scholar]


